BCMA于1992年在巴黎Génétique Moléculaire研究所的Andrea Tsapis实验室发现,它能识别出成熟的B淋巴细胞,并且在功能上促进了这些“细胞哨兵”(免疫系统的前线部队)的寿命。但它也有助于变异的B细胞存活,而变异的B细胞是多发性骨髓瘤的特征,多发性骨髓瘤是一种相对常见且仍无法治愈的骨髓细胞癌。
对于药物研发人员来说,BCMA显然是设计治疗该病药物的第一个选择。开发细胞和基因治疗的Poseida Therapeutics公司总裁兼首席商务官马克·格根(Mark Gergen)说:“BCMA是一个经过科学验证的多发性骨髓瘤靶点,在商业意义上,它成为一个‘衍生’靶点。在多发性骨髓瘤中,可能有多个不同的靶点。”CAR自然杀伤(NK)细胞的开发者Fate Therapeutics首席开发官鲍勃·瓦拉梅尔(Bob Valamehr)认为:“BCMA是最全面的,如果想获得大部分多发性骨髓瘤患者,这是开始的基础。”
在2020年12月举行的美国血液学学会(ASH)会议上,许多开发BCMA靶向药物治疗多发性骨髓瘤的领先公司发布了数据。临床上所有三类BCMA靶向免疫疗法——ADCs、T细胞结合双特异性抗体和CAR T细胞治疗具有显著的抗肿瘤活性。不过,格根指出,BCMA疗法有相当可观的应答率,一些药物同时也有严重的毒性。
抗体的机会:BCMA药物研发重要回顾
早期针对BCMA的药物是ADCs:葛兰素史克(GSK)的Blenrep(belantamab mafodotin)于2020年8月获得美国FDA的批准,并制定了BCMA靶向药物的疗效标准,但目前该标准已经被超越。
临床医生和股票分析师经常将癌症试验的数据简化为一个简单的数字,即总有效率(ORR)——接受治疗有肿瘤缩小迹象的患者比例。Blenrep批准时基于的DREAMM-2临床试验,ORR为31%。这在许多其他治疗失败的患者中是一个令人印象深刻的结果。如果要使用Blenrep,患者必须至少对四种先前的治疗没有反应,包括抗CD38单克隆抗体、蛋白酶体抑制剂和免疫调节剂。
目前至少还有两种基于BCMA的ADCs正在开发中。阿斯利康MEDI2228的1期研究数据在2020年的ASH上发布,其最佳剂量的ORR为61%。此外,Heidelberg制药公司的HDP-101正处于临床前阶段。
ADCs是有效的,但有严重的副作用。Blenrep的批准附带了一个关于眼部毒性的黑框警告,包括严重的视力丧失,而在MEDI2228的1期试验中,不良事件阻止了大多数患者使用该药物,即使是在最大剂量减小的情况下。
同时,其他BCMA导向的平台,如T细胞结合双特异性抗体和CAR T细胞治疗似乎表现更好(虽然直接比较受到研究中患者群体差异的阻碍)。在多发性骨髓瘤领域,目前至少7个BCMA导向的T细胞连接器的数据在ASH上公布,ORRs在63-83%之间,但有大量的毒性。
最难控制的不良反应之一是细胞因子释放综合征,部分人认为这是由旁观者免疫细胞的普遍激活引起的级联反应。细胞因子释放综合征的部分解决方案可能在于研发复杂治疗实体的组成。
T细胞连接器(或双特异性抗体)结合两种抗体样部分:一种附着于肿瘤特异性抗原(例如BCMA),另一种(抗CD3抗体)结合患者内源性肿瘤细胞杀伤T细胞上的CD3抗原。目前尚不清楚BCMA/CD3双特异性哪种最有效,但其临床特性可能取决于成分的性质和来源。
例如,再生元在ASH发布的数据显示,其REGN5458是目前BCMA/CD3双特异性抗体中最安全的一种。但仍有39%的患者出现细胞因子释放综合征。再生元在REGN5458、REGN5459之后还有另一种BCMA/CD3双特异性抗体。该公司血液学转化和临床科学高级副总裁安德烈斯·瑟鲁尼克(Andres Sirulnik)指出:“二者主要区别在于抗CD3臂对CD3的亲和力,可能通过调节CD3参与的强度,以优化T细胞活化,从而提供一个不同的药代动力学特征和治疗窗口。”
一个更宽的治疗窗口意味着一种化合物不必在接近最大耐受剂量的浓度下给药:对开发者来说,这样有更大的回旋余地。对于免疫治疗,抗体与靶点结合的精确方式将影响治疗窗口。对于连接器来说,T细胞结合的性质(例如通过CD3)也可能改变临床表现。
TeneoBio是一家小型的域抗体开发公司,不仅与许多公司在抗体靶向癌症治疗领域开展合作,而且正在开发自己的BCMA/CD3双特异性接合器TNB-383B。TNB-383B是TeneoBio免疫治疗工具平台的展示:它由两个单独的BCMA结合抗体域和一个来自TeneoBio的“即插即用”CD3抗体库的CD3+T细胞连接器。
TeneoBio首席商务官奥米德·瓦法(Omid Vafa)说:“我们将多种CD3结合物与不同的肿瘤抗原结合。这些靶点可能是同一抗原上的双副抗原表位,也可能是两个独立的肿瘤抗原。”这种结构的灵活性使TeneoBio能够与吉利德的Kite制药部门、Poseida Therapeutics和ArsenalBio签订合作协议,开发CAR T产品,并与GSK收购的Tesaro以及强生共同开发多特异性抗体。值得注意的是,与GSK的交易涉及实体癌的治疗,这是多特异性靶向抗体的新领域。
TeneoBio更广泛的计划是将其治疗资产分拆成独立的业务部门。一部分被称为TeneoOne,一种包含靶向BCMA的TNB-383B的工具。艾伯维是TeneoBio的BCMA项目合作伙伴,为开发提供资金,在1期研究完成之前或之后不久,他可以选择收购TeneoOne。
扩大细胞治疗库
ASH大会上针对BCMA的两种CAR T细胞产品的ORR数据令人印象深刻:强生cilta-cel(LCAR-B38M CAR T细胞)的缓解率为97%,蓝鸟生物bb21217的缓解率为73%,尽管同样受到广泛的毒性反应限制。强生于2017年与传奇生物公司就LCAR-B38M达成合作,协议涉及3.5亿美元的预付款(见表1),随后该药物在当年早些时候举行的美国临床肿瘤学会(ASCO)年会上给研究者们留下了深刻印象。
尽管多家制药、生物技术公司都在积极开发T细胞连接器,但致力于CAR T细胞治疗的公司却很少。到目前为止,该领域主要是针对另一种B细胞抗原CD19的治疗淋巴瘤的自体细胞疗法。
诺华最初与宾夕法尼亚大学Carl June的团队合作,率先开发了首款CAR T细胞产品,即2017年美国FDA批准的CD19靶向tisagenlecleucel。同样在2017年,吉利德以119亿美元收购了Kite制药,并将另一种CD19靶向CAR T细胞疗法Yescarta(Axicabatgene ciloleucel)推向市场。但百时美施贵宝(BMS)通过2019年收购新基,获得了CAR T先锋Juno,该公司正努力将其CD19靶向liso-cel通过美国FDA批准,最终于2021年2月获得批准。
BMS还在等待美国FDA对ide-cel的决定,ide-cel是一种BCMA靶向的治疗多发性骨髓瘤的CAR T细胞疗法。与此同时,该公司已经停止了第二种BCMA靶向CAR T细胞疗法orva-cel的研发,注销了4.7亿美元的成本。当技术发展迅速时,备用CAR T细胞疗法可能会被剩下。
表1 涉及BCMA靶向治疗的近期交易(2017-2020)
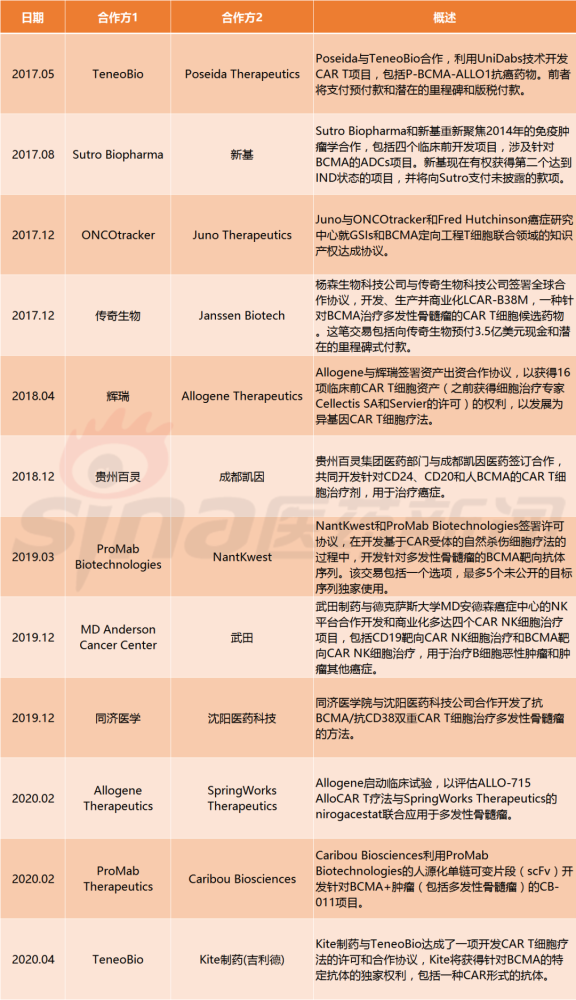
大制药公司可能不喜欢定制的自体T细胞治疗产品。然而,现成的异基因细胞疗法看起来更像传统的“瓶装药物”。如果他们在临床试验中取得成功,制药公司对细胞治疗的热情可能会迅速改变。“一旦有人破解了异基因CAR T上的代码,就会看到一股喂食狂潮,”格根说:“多家大型公司在肿瘤学领域有着可观的销售额,但在细胞治疗方面几乎没有历史成绩。如果异基因细胞疗法如承诺的那样奏效,他们就必须接受,因为他们的大部分收入和渠道都可能面临风险。”
在某些领域,CAR T细胞技术是模块化组装。Poseida有三种针对多发性骨髓瘤的BCMA导向细胞产品。P-BCMA-101是一种自体产品,可以回收病人自己的细胞;P-BCMA-ALLO1是一种异基因版本,其中基因编辑被用来消除交叉反应功能;而双重CAR T(BCMA/CD19)是针对两种多发性骨髓瘤抗原的异基因细胞的进一步调整。
Poseida公司研发主管德文·谢德洛克(Devon Shedlock)说:“原型自体产品P-BCMA-101让公司学到了很多关于制造、安全性和效力筛选的知识,最重要的是了解到干细胞记忆T细胞(Tscm)的重要性。疾病复发或对治疗产生耐药性的机制之一是,许多CAR T细胞不会粘附在周围。但如果能制造出一种含有Tscm细胞的产品,使它们能够(在骨髓中)植入,那么就可以降低复发的可能性。”对于异基因治疗来说,持续使用Tscm细胞在患者体内产生长期的骨嵌合体是改善预后的另一种机制。谢德洛克认为:“异基因细胞来自不同的人,如果异基因细胞不能存活或移植,目前还不清楚没有Tscm细胞是否有可能产生持久的反应。”
在设计模块化和系统化的系统时,其他公司已经转向NK细胞-淋巴细胞,与T细胞不同的是,它们不必被抗原呈递细胞启动。早期临床应用CAR-NK细胞已显示出显著降低细胞因子释放综合征和神经毒性。此外,由于它们不会引起移植物抗宿主反应,它们可能天生适合现成的同种异体应用。
NK细胞面临的主要挑战是,它们比T细胞更难工程化。“NK细胞只是不喜欢吸收DNA,不管是通过转导还是转染。”瓦拉梅尔说。因此,Fate Therapeutics在发展NK细胞的祖细胞中进行工程和DNA编辑。在包装了所有正确的属性后,iPSC可以作为一个现成的制造过程的主细胞系。就像单克隆抗体一样。
Fate的BCMA靶向产品即将进入临床,说明了CAR-NK细胞组装的模块化性质。该候选疗法包含激活NK细胞活性的高亲和力CD16受体、使NK细胞持续存在的IL-15受体融合和靶向多发性骨髓瘤细胞的BCMA CAR。除此之外,CD38的表达被敲除,以防止该药物在与强生Darzalex(daratumumab)等抗CD38抗体联合使用时自毁。
在BCMA产品领先的地方,其他的靶向免疫疗法也可能接踵而至。异基因T细胞疗法和CAR-NK细胞产品等产品的临床开发不仅建立在自体细胞技术的经验基础上,而且建立在双特异性抗体和其他T细胞参与变异体的临床表现的知识基础上。在制造和掌握宿主抗移植物排斥反应方面的一致性后,可能会减缓不良反应的发展,但BCMA靶向药物正在开辟一条具有更持久疗效的癌症治疗发展道路。
文章参考:
Will blood cancer medical advances begin with BCMA?
文章来源|新浪医药

