责编丨迦溆
以T细胞为基础的免疫疗法已经成为肿瘤治疗的重要手段之一。靶向PD-1和CTLA4等的免疫检查点阻断疗法、嵌合抗原受体T细胞(CAR-T)疗法等免疫治疗方法已被批准应用于临床肿瘤治疗,并取得了很好的治疗效果【1,2】。但限于肿瘤微环境的免疫抑制以及其调控的复杂性,现有以T细胞为核心的免疫疗法仍然存在一些限制,特别是临床上有许多患者对PD-1/L1抗体抑制剂不敏感或者很快耐药,因此仍需进一步探究肿瘤免疫抑制微环境的形成机制。
肿瘤微环境的免疫抑制除了来源于肿瘤相关巨噬细胞、MDSC和Treg细胞等免疫抑制型的细胞以及免疫抑制的细胞因子外,近些年的研究发现代谢调控也参与了免疫抑制微环境的形成,葡萄糖、氨基酸以及脂质代谢异常参与抑制肿瘤浸润CD8+ T细胞的抗肿瘤活性【3,4】。作为细胞的重要组成成分,胆固醇及其代谢通路已经被证实调控T细胞的免疫应答,以及抗肿瘤免疫反应【5-7】,然而肿瘤微环境如何重塑T细胞的胆固醇代谢并介导免疫逃逸,目前尚不清楚。

近日,南方医科大学的杨魏、丁彦青和张镇海团队在在Protein & Cell以研究长文(Research Article)形式在线发表题为 Potentiating CD8+ T cell antitumor activity by inhibiting PCSK9 to promote LDLR-mediated TCR recycling and signaling的论文,研究发现肿瘤微环境可以通过胆固醇代谢中的核心调控因子PCSK9抑制CD8+ T细胞中低密度脂蛋白受体LDLR(low-density lipoprotein receptor)的表达,从而抑制CD8+ T细胞的抗肿瘤活性,证实了PCSK9可以作为肿瘤免疫治疗的新靶点,为进一步基于PCSK9开发新型抑制剂或单抗用于临床肿瘤治疗具有重要意义。

为了回答T细胞胆固醇代谢在肿瘤微环境中发生了怎样的变化,研究人员通过对临床肿瘤样本,并结合小鼠肿瘤模型,发现肿瘤微环境诱导杀伤性CD8+ T细胞胆固醇代谢发生系统性重编程,导致肿瘤浸润CD8+ T细胞胆固醇水平降低。然而肿瘤组织中并不缺乏胆固醇的存在,因此研究者将焦点聚焦在负责转运胆固醇的低密度脂蛋白受体LDLR上,发现肿瘤微环境从转录水平和蛋白水平上抑制LDLR的表达。
接下来研究人员针对LDLR在T细胞中的功能展开研究。LDLR是细胞膜上低密度脂蛋白转运体,负责将细胞外低密度脂蛋白LDL转运至细胞内,进而向细胞提供胆固醇等脂质分子。通过基因敲除小鼠,研究者发现LDLR缺失会抑制CD8+ T细胞活化、增殖以及其效应功能。由于LDLR的经典功能是转运低密度脂蛋白,为进一步验证LDLR引起的CD8+ T细胞缺陷来自于胆固醇的减少,研究者利用无脂蛋白培养系统处理原代CD8+ T细胞,发现除CD8+ T细胞的增殖依赖于LDLR的脂蛋白转运功能,其效应功能包括细胞因子表达、靶细胞杀伤等主要依赖于LDLR的表达,而非其转运的低密度脂蛋白LDL,尤其是在活化的杀伤性CD8+ T细胞上,表明LDLR调控CD8+ T细胞功能除了通过转运低密度脂蛋白外还存在其他调控方式。
为进一步研究LDLR在CD8+ T细胞中的非经典调控作用,研究人员对CD8+ T细胞的活化信号通路进行了系统性分析,发现LDLR调控T细胞抗原受体TCR的活化信号,而且这种调控作用并不完全依赖于细胞质膜上胆固醇水平的变化。进一步研究者通过成像以及生化以及免疫学等方法,发现LDLR与TCR存在相互作用,参与调控TCR的内吞-再回收以及跨膜信号转导,揭示了LDLR除了转运低密度脂蛋白外的另外一个非经典功能,提示LDLR作为膜蛋白可能参与更多重要膜受体的跨膜信号转导及其功能。
研究人员接着将研究聚焦在肿瘤微环境调控CD8+ T细胞LDLR的机制上。通过过继细胞转移治疗的小鼠肿瘤治疗模型,研究人员发现给荷瘤小鼠注射肿瘤抗原特异性CD8+ T细胞后,在T细胞浸润的早期(注射后24小时),肿瘤浸润的CD8+ T细胞膜上LDLR水平显著下降,而其转录水平并没有明显变化,提示肿瘤微环境抑制CD8+ T细胞LDLR是通过转录后机制。
前蛋白转运酶枯草溶菌素9(Proprotein convertase subtilisin/kexin type 9, PCSK9)是LDLR的重要负调控蛋白,可与细胞质膜上的LDLR结合并共同转运至溶酶体,促进LDLR的降解而使得LDLR无法循环至细胞质膜上重新再利用【8】。研究人员通过TCGA数据库分析和对临床肿瘤样品进行分析,发现多种肿瘤组织高表达PCSK9,且影响肿瘤病人预后。而且研究者还发现肿瘤组织中 PCSK9的水平与T细胞在肿瘤中的浸润程度呈负相关,提示肿瘤细胞PCSK9的高表达可能与肿瘤免疫逃逸相关。因此研究者进一步在肿瘤细胞中敲除PCSK9,然后通过多种肿瘤免疫动物模型验证PCSK9的免疫调控作用,发现在免疫完全小鼠上,PCSK9敲除显著抑制肿瘤的进展,而在T细胞缺陷的Rag2-/-小鼠上以及经历CD8+ T细胞清除的小鼠上,肿瘤细胞PCSK9敲除不影响其进展。而且,研究者还进一步通过过继细胞转移治疗的小鼠肿瘤治疗模型,验证肿瘤PCSK9敲除导致的进展减慢是否依赖于CD8+ T细胞LDLR的表达,发现肿瘤细胞来源PCSK9主要通过作用于CD8+ T细胞上LDLR受体,参与肿瘤免疫逃逸。
PCSK9目前已经是治疗高胆固醇血症的有效药物靶点【9】。为进一步探索PCSK9作为肿瘤免疫治疗靶点的可能性,研究人员利用了一种抑制PCSK9翻译的小分子抑制剂PF-06446846在小鼠体内尝试肿瘤治疗,发现该抑制剂能有效抑制肿瘤的进展,且这种治疗效果依赖于T细胞的存在。进一步研究人员尝试将PCSK9抑制剂与免疫治疗药物PD-1抗体联用,发现联用效果更佳。
值得指出的是,在该研究在准备投稿阶段(2020年12月4日投稿至BioRxiv, https://biorxiv.org/cgi/content/short/2020.12.03.403121v1),2020年11月11日Nature在线发表题为Inhibition of PCSK9 potentiates immune checkpoint therapy for cancer 的文章(详见BioArt报道:Nature | 抑制PCSK9增强肿瘤免疫治疗效果)证实肿瘤细胞内PCSK9具有肿瘤免疫调节功能,抑制PCSK9可增强肿瘤免疫治疗效果【10】。虽然机制上不一致,但两项工作都一致证实PCSK9可作为潜在的治疗靶点用于肿瘤免疫治疗。
总体而言,该研究从胆固醇代谢的角度,通过一系列的研究,证实了低密度脂蛋白受体LDLR在CD8+ T细胞抗肿瘤免疫应答中起着关键调控作用,发现了LDLR可作为膜蛋白调控TCR信号这一新的调控机制,进一步发现肿瘤细胞来源的PCSK9通过调控CD8+ T细胞LDLR表达及其免疫应答参与肿瘤免疫逃逸(图2),且初步评估了PCSK9作为药物靶点用于肿瘤免疫治疗的潜在能力。
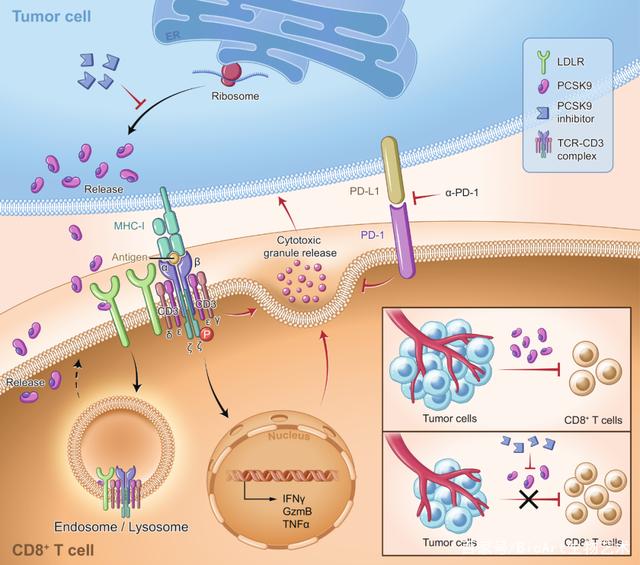
图2. PCSK9-LDLR调控TCR活化信号参与CD8+ T细胞肿瘤免疫应答
该研究工作由南方医科大学杨魏团队、丁彦青团队以及张镇海团队合作共同完成。南方医科大学博士后袁娟娟、蔡婷、郑晓君和博士研究生任阳子为论文的共同第一作者。
原文链接:
https://doi.org/10.1007/s13238-021-00821-2
南方医科大学杨魏团队主要从事免疫代谢与肿瘤免疫相关的基础及转化研究工作,团队诚聘博士后研究人员。
专家点评
叶丽林 (陆军军医大学全军免疫学研究所,教授)
肿瘤特异性的CD8 T细胞可以直接杀死肿瘤细胞,发挥免疫监视作用。但是,肿瘤细胞通过免疫编辑等多种方式,逃逸CD8 T细胞的杀伤,从而形成肿瘤组织,并建立异质性免疫微环境。
南方医科大学杨巍课题组及其合作者等在Protein & Cell最新报道了一种全新的肿瘤免疫逃逸方式。他们发现肿瘤细胞高表达调控胆固醇水平的前蛋白转化酶枯草溶菌素/Kexin 9型,即PCSK9,其可以和CD8 T细胞的低密度脂蛋白受体LDLR结合,将其递送至溶酶体降解。更重要的是,他们发现CD8 T细胞上,LDLR还可以直接和的TCR受体复合物结合,介导TCR复合物上膜循环,免于被递送至溶酶体降解,从而保证TCR信号的活化强度。但是,肿瘤来源的PCSK9“劫持”了CD8 T细胞膜上的LDLR,阻断LDLR介导的TCR受体上膜循环,从而削弱了CD8 T细胞通过TCR杀伤肿瘤细胞的能力。
有意思的是,与他们此前的工作不同(Yang et.al, Nature, 2016)(通讯作者为上海生化所的许琛琦研究员),胆固醇代谢本身并不参与PCSK9介导的免疫逃逸。另外,最近的另一项工作(Liu et.al, Nature, 2020)也报道了肿瘤细胞来源的PCSK9介导的免疫逃逸。此两项工作的表型基本相同,都证明了PCSK9通过非胆固醇代谢的方式实现免疫逃逸,以及靶向PCSK9可以促进CD8 T细胞的抗肿瘤功能,并能协同提高PD-1免疫检查点的效力。但是,二者机制的解析并不一样,Nature的报道认为PCSK9主要是通过阻断肿瘤细胞本身的MHC-I上膜循环,而杨巍课题组认为肿瘤的PCSK9通过类似的trans作用方式,直接靶向CD8 T细胞上的TCR复合物。这两种机制可能同时存在,但需要更进一步的验证。考虑到PCSK9的靶向单抗已经上市用于降低胆固醇治疗,该项研究为下一步在肿瘤临床开展抗PCSK9及PD-1的联合免疫治疗提供了重要的理论依据。
专家点评
王红艳(中科院上海生化细胞所,研究员)
该研究主要发现低密度脂蛋白受体(LDLR)调控CD8+ T细胞抗肿瘤的功能和机制。除外经典的介导低密度脂蛋白(LDL)的摄取功能之外,作者发现LDLR作为膜蛋白与CD8+ T细胞TCR/CD3复合体相互作用,调控TCR在细胞膜的水平,进而影响T细胞活化和增殖。这种LDLR的非经典功能从未被报道过,也带来其他一些有意思的问题,包括LDLR是否直接结合CD3?或者肿瘤微环境例如不同细胞因子是否调控LDLR结合CD3的水平?此外,本研究另一个重要发现是肿瘤组织高表达LDLR的负调控蛋白PCSK9。PCSK9介导CD8+ T细胞LDLR内吞和降解,进而抑制TCR信号通路和CD8+T细胞抗肿瘤活性。有潜在转化价值的是,抑制肿瘤细胞来源PCSK9可缓解肿瘤微环境对CD8+ T细胞耗竭的影响。这个创新的发现促使我们更多思考:是否有某类型肿瘤或者在肿瘤发展的不同阶段出现高表达PCSK9的现象?这将为更好靶向PCSK9以提高肿瘤免疫治疗效果提供重要线索。总之,该文章的数据量大,提供多个新颖的视角去解析CD8+ T细胞抗肿瘤的机制&肿瘤微环境操纵CD8+ T细胞耗竭的新机制。最后,该文章图7的model构图也很漂亮,值得大家参考学习。
专家点评
王迪(浙江大学医学院,教授)
胆固醇代谢对于免疫细胞功能发挥及其在肿瘤微环境中的异常调控已成为当前免疫代谢和肿瘤免疫研究领域的重要前沿科学问题。胆固醇在细胞中的代谢途径包括吸收、外排、合成、储存。我国科学家在胆固醇代谢调控CD8+T细胞功能及其在肿瘤中的潜在应用做出重要的探索性工作。比如2016年发现抑制CD8+T细胞中的胆固醇酯化酶(ACAT1)降低细胞中胆固醇的存储可以通过增加细胞膜上的胆固醇含量从而增强CD8+T细胞抗肿瘤活性(Yang et al., 2016)。利用曾进入临床三期试验的Avasimibe抑制ACAT1的活性并与anti-PD-1抗体联用可以显著提高肿瘤杀伤的效果,提示ACAT1作为潜在肿瘤免疫治疗靶点的重要意义。除了胆固醇存储,其他胆固醇相关代谢通路是否同样参与调控T细胞的免疫功能及其肿瘤杀伤能力?南方医科大学基础医学院的杨魏教授在本工作中针对胆固醇代谢的另一重要途径,LDLR介导的胆固醇摄取,系统地开展了其对CD8+ T效应细胞功能以及抗肿瘤能力的研究。研究发现LDLR通过一种胆固醇非依赖的方式直接与TCR互作并调控其在细胞膜上的表达以及下游信号。本研究的另一亮点体现在发现了肿瘤中LDLR重要的负调分子PCSK9存在异常表达,并通过一系列体内实验证实靶向PCSK9可以显著增强CD8+T细胞的抗肿瘤能力。
值得一提的是,去年底的一篇Nature论文同样发现了抑制胆固醇代谢调节因子PCSK9可以显著增强抗肿瘤免疫治疗(Liu et al., 2020)。两篇论文同时揭示PCSK9作为重要的肿瘤免疫治疗靶点,为今后进一步开展PCSK9的临床试验提供重要的理论基础。尽管两篇论文在机制上不尽相同:Nature论文认为主要对肿瘤细胞MHC-I分子的调控,而本文认为主要是对T细胞的TCR分子的调控,但是这些差异可能更加说明PCSK9在肿瘤微环境中的复杂机制。考虑到目前已经有两款PCSK9人源化抗体,包括Evolocumab和Alirocumab已经被用于临床治疗高胆固醇血症,因此更加令我们对未来靶向PCSK9进行抗肿瘤治疗充满期待。
总结下来,笔者认为本文的价值体现在:1. 进一步发现胆固醇代谢通路可以直接参与免疫分子和信号的调控,体现了代谢-免疫在进化上可能存在高度“协同”的特性;2. 为肿瘤免疫提供了一个新的具有潜力的分子靶点。

参考文献
1 Maude, S. L. et al. Chimeric antigen receptor T cells for sustained remissions in leukemia. N Engl J Med371, 1507-1517, doi:10.1056/NEJMoa1407222 (2014).
2 Wolchok, J. D. et al. Nivolumab plus ipilimumab in advanced melanoma. N Engl J Med369, 122-133, doi:10.1056/NEJMoa1302369 (2013).
3 Bian, Y. et al. Cancer SLC43A2 alters T cell methionine metabolism and histone methylation. Nature585, 277-282, doi:10.1038/s41586-020-2682-1 (2020).
4 Chang, C. H. et al. Metabolic Competition in the Tumor Microenvironment Is a Driver of Cancer Progression. Cell 162, 1229-1241, doi:10.1016/j.cell.2015.08.016 (2015).
5 Kidani, Y. et al. Sterol regulatory element-binding proteins are essential for the metabolic programming of effector T cells and adaptive immunity.Nat Immunol 14, 489-499, doi:10.1038/ni.2570 (2013).
6 Yang, W. et al. Potentiating the antitumour response of CD8(+) T cells by modulating cholesterol metabolism. Nature531, 651-655, doi:10.1038/nature17412 (2016).
7 Wang, F., Beck-García, K., Zorzin, C., Schamel, W. W. & Davis, M. M. Inhibition of T cell receptor signaling by cholesterol sulfate, a naturally occurring derivative of membrane cholesterol. Nat Immunol17, 844-850, doi:10.1038/ni.3462 (2016).
8 Poirier, S. et al. The proprotein convertase PCSK9 induces the degradation of low density lipoprotein receptor (LDLR) and its closest family members VLDLR and ApoER2.J Biol Chem 283, 2363-2372, doi:10.1074/jbc.M708098200 (2008).
9 Raal, F. J. et al. Inhibition of PCSK9 with evolocumab in homozygous familial hypercholesterolaemia (TESLA Part B): a randomised, double-blind, placebo-controlled trial. Lancet 385, 341-350, doi:10.1016/s0140-6736(14)61374-x (2015).
10 Liu, X. et al. Inhibition of PCSK9 potentiates immune checkpoint therapy for cancer. Nature588(7839), 693-698, doi:10.1038/s41586-020-2911-7

